美国FDA批准了诺华的CAR-T细胞治疗药物Kymriah(tisagenlecleucel,CTL019)第二个适应症,以用于治疗复发或难治性大B细胞淋巴瘤的成人患者(先前接受过两次或以上的系统治疗),其中包括最常见的非霍奇金淋巴瘤形式—弥漫性大B细胞淋巴瘤(DLBCL)以及起因于滤泡性淋巴瘤(FL)的高级别B细胞淋巴瘤和DLBCL。值得注意的是,这是FDA授予诺华的CAR-T细胞治疗药物Kymriah的第二个适应症。2017年8月30日,美国FDA已经批准诺华公司的突破性CAR-T疗法Kymriah,治疗罹患B细胞前体急性淋巴性白血病(ALL),且病情难治,或出现二次及以上复发的25岁以下患者,是人类历史上批准的首款CAR-T细胞产品。
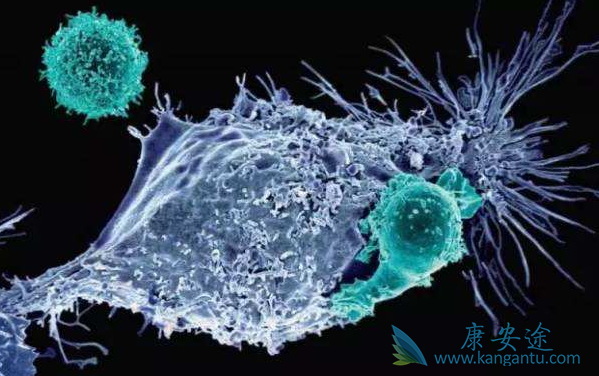
据相关数据显示,DLBCL影响约30%的NHL患者,且美国每年大概有27000例新诊断的DLBCL病例,其中这些患者中约有6500名患者在接受两种或两种以上的治疗后出现复发或难治性疾病,而这些患者现在可能有资格接受CAR-T疗法Kymriah治疗。去年美国血液学会(ASH)年会上,诺华和宾夕法尼亚大学(Penn)共同公布了关于Kymriah (CTL019)的一项关键研究新数据(JULIET)。在这项名为JULIET的全球关键II期临床试验中,研究人员评估了Kymriah(CTL019)在复发/难治性DLBCL患者中的疗效,临床结果证实了该疗法的持久性。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)