在第一代CAR设计进行的临床试验中,对于多种肿瘤的治疗结果均令人失望。2011年,第二代CAR-T细胞靶向CD19和编码共刺激结构域成为了T细胞基因改造方法治疗肿瘤的模板。其特征使得CD19成为几乎理想的靶标。它显示出在B细胞恶性肿瘤中的常见性和高水平表达,而且需要人体正常B细胞的发育,但是不表达B细胞系以外的细胞谱。采用CD19 CARs成功治疗的患者通常表现出显著的B细胞发育不良,因此CAR-T细胞治疗后的B细胞缺失,主要通过静脉注射免疫球蛋白的替代疗法进行改善。
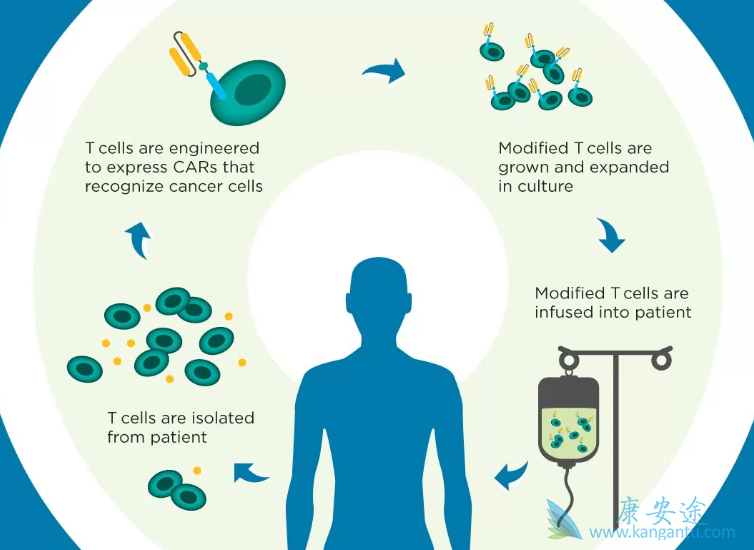
早期关于CAR-T细胞作用于其它靶点的试验结果表明,CD19引发的非肿瘤交叉反应并非特例,但是可能在其它同系靶点中也观察到相同反应。例如多发性骨髓瘤表达低水平CD19,采用CD19 CAR-T细胞治疗也有效。正在进行的CARs靶向B细胞成熟抗原(BCMA或CD269)的晚期骨肉瘤临床试验(NCT 02546167)中,除了恶性骨肉瘤细胞外,表达BCMA的良性浆细胞也被清除。
非肿瘤反应的耐受程度主要依赖于靶向非癌细胞的类型。通过CD19-特异CAR-T细胞疗法,大部分白血病复发患者达到完全治愈,但也出现了两种耐受类型。一类是缺失CART细胞靶向CD19抗原表位的急性白血病,导致肿瘤逃逸。全球临床试验中,CD-19阴性缺失变异的年轻和儿童急性白血病患者的复发率通常达到28%。另一类是慢性淋巴细胞(CLL)白血病,CLL的耐受可能是由于CART细胞注射后的增殖失败。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)