PD-1抑制剂在这两年发展十分的迅速,目前国内有已经多个药企开展了临床试验。并且目前全球知名的两款PD-1抑制剂已经申请在中国上市、相信在2018年就会正式上市。国内的癌症患者就能够使用新的治疗方案。
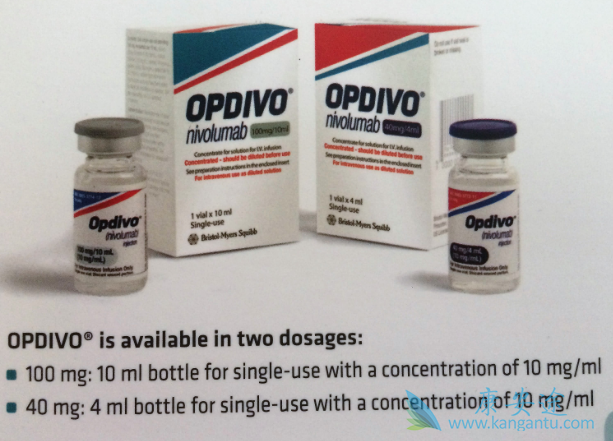
2018年2月8日,国家食品药品监督管理总局药品审评中心(CDE)发布了《抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求》,针对抗PD-1/PD-L1单抗品种面对的研发和申报问题给予明确的政策指引和“Pre-NDA会议”“优先审评”“审评提速”等配套支持,对于允许企业以客观缓解率(ORR)为主要终点的但比临床研究结果提交上市申请,允许企业以滚动申请形式分阶段提交临床数据。

2018年3月初,阿斯利康公布其免疫疗法药物Imfinzi(durvalumab)已正式获得美国食品药品监督管理局(FDA)批准,用于治疗不能手术切除的III期非小细胞肺癌(NSCLC)患者。早在2017年5月,Imfinzi便已获FDA加速批准用于治疗在含铂化疗期间或之后或在含铂新辅助或辅助化疗12个月之内病情恶化的局部晚期或转移性尿路上皮癌,而此次获批的适应症在2017年8月获得了美国FDA的突破性疗法认定资格。2018年3月14日,默沙东(MSD)公司宣布美国FDA接受了该公司为抗PD-1疗法Keytruda (pembrolizumab) 递交的补充生物制剂许可申请 (sBLA),并且授予其优先审评资格。这项申请使用pembrolizumab治疗接受化疗之后癌症继续恶化的晚期宫颈癌 (cervical cancer) 患者。这是FDA接受的第14项关于pembrolizumab的监管申请。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)