2017年8月,FDA批准了Novartis CAR-T细胞治疗(Kymriah)用于治疗小儿和青少年B细胞急性白血病。紧接着在10月份批准了Kite Pharma的Yescarta细胞治疗产品,用于治疗难治复发的成人大B淋巴细胞白血病。这两种产品都是在患者接受治疗的机构采用单采机收集起始细胞的。新鲜细胞(Yescarta)或冻存细胞(Kymriah)被运送到公司的GMP车间进行制备CAR-T细胞,然后发送到治疗中心进行输注。问题是商业化来源能否满足产品的预期要求。鉴于目标是在自动的,密闭功能的设备中生产每个患者的细胞,且每个患者都需要一个系统,设备的可用性可能成为一个限制因素。商业化产品的治疗费用大于37.3万美元,而其生产成本则小于4万美元。

基因改造后,CAR-T细胞的体外扩增要达到临床使用数量的要求。大量的系统被使用,从简单的T型瓶到细胞培养袋再到复杂的生物反应器生产。理想的系统应具有密闭功能,减少污染的风险,因此大量的研究人员放弃了使用T型瓶。冻存CAR-T细胞是为了长期储存。最长用的方法是根据造血干细胞开发的程序,将其重新悬浮在含10%的DMSO中,然后在气相液氮罐中储存。据报道这个程序可以维持CAR-T细胞的免疫表型和活性功能。但并不总是使用例如NK细胞。多年来,用于冻存的介质已经从研究级别向USP级别电解质溶液转变,例如添加了HSA的PlasmaLyte A。
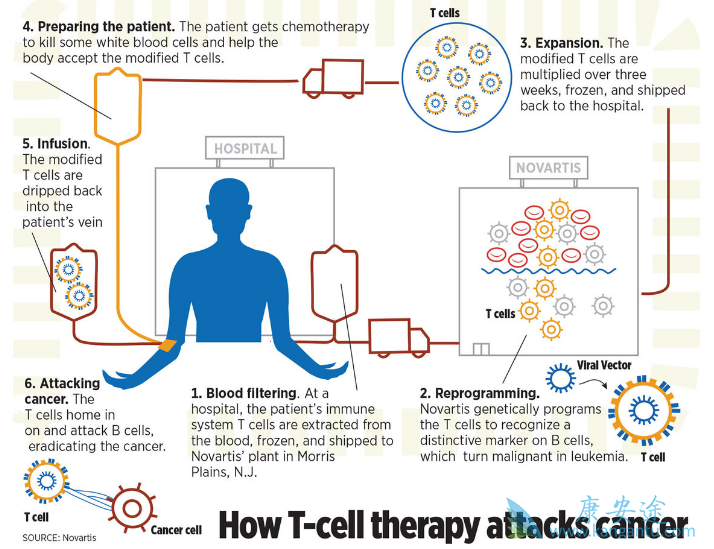
CAR-T细胞在治疗白血病方面的影响刺激了它在治疗实体瘤方面的探索应用。这个方面取得了快速的发展,仅在2017年在PubMed上就有417篇文章发表。同样的,细胞产品的生产也在快速的发展,本文只是起到了“快递”功能。CAR-T功无疑刺激了新技术、试剂、原材料和设备的开发,甚至新的审批法规,所有这些都有可能将细胞疗法进一步推出医疗标准。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)