CART细胞治疗方法的原理是通过体外的基因改造,将CAR安装到T细胞上,进行体外扩增,最后回输到患者体内使其能够特异性识别并杀死癌细胞。经历了三代的发展。第一代CAR介导的T细胞激活是通过CD3ζ链或FceRIg上的酪氨酸激活基序完成的。CD3ζ链能够提供T细胞激活、裂解靶细胞、调节IL-2分泌以及体内发挥抗肿瘤活性所需的信号。但第一代CAR改造T细胞的抗肿瘤活性在体内受到了限制,T细胞增殖减少最终导致T细胞的凋亡。第二代CAR在胞内增加了一个新的共刺激信号,常用的共刺激分子为CD28和CD137(4-1BB)。第三代CAR,增加了额外的共刺激信号,目前正在研究的第四代CAR-T则在为治疗的安全性考虑,增加了自杀基因等便于在T细胞完成抗癌作用后的体内消除,从而避免毒副作用。
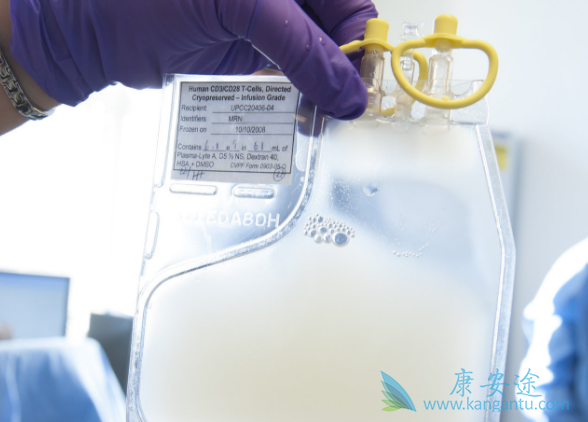
CART细胞治疗还可以分为自体和通用的两种,患者的自体T细胞取出来进行改造,回输的治疗相对安全性较高,但由于很多癌症晚期的病患的自体T细胞已经非常虚弱,很难进行体外改造,体外扩增的数量往往非常有限,则考虑亲缘关系近的亲属或者通用性的CAR-T技术,即异源的T的免疫原性相关因素去除,在体外进行改造驯化,再回输给患者,这种通用性的CAR-T技术又被称为UCAR-T,国内外已经有很多新型的公司在做这方面的研究,结合最近CRISPR技术进行T细胞的体外改造,使其适用于大众患者,从而节约成本和治疗时间。
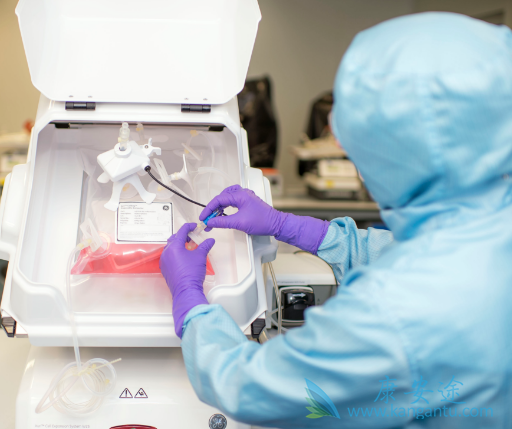
2017年,FDA(美国食品药品监管局)率先批准了全球第一、第二个CAR-T疗法上市,来自诺华公司的Kymriah和吉利德旗下Kite制药的Yescarta分别获批治疗特定类型的急性淋巴细胞瘤和大B细胞淋巴瘤,2017年被称为细胞免疫治疗的“元年”,2017年 12月11日,南京传奇生物科技有限公司(金斯瑞旗下的全资子公司)申报的LCAR-B38MCAR-T细胞自体回输制剂新药注册已被正式受理,2018年3月12日上午10点,国家药监局批准了LCAR-B38MCAR-T细胞自体回输制剂临床试验申请,这是我国首例获受理的CAR-T疗法。
















请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)