由于受国外诺华、Kite及我国2017年底有关细胞治疗领域政策的落地,火热的CAR-T免疫疗法在2018年成为医药行业的焦点。作为近年来被认为癌症治疗领域最成功的方法之一,以CAR-T为代表的细胞免疫疗法备受推崇,国内制药企业所上的CAR-T疗法临床试验呈现井喷之势。
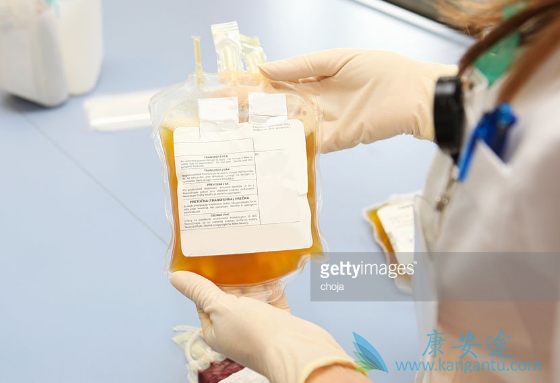
2018年3月13日,CDE公布了《细胞治疗产品申请临床试验药学研究和申报资料的考虑要点》(以下简称《要点》),继2017年12月CFDA颁布《细胞治疗用产品的研究与评价技术指导原则》之后,这是为按照药品研发的细胞治疗类产品提供规范性文件和申报路径。
CAR-T在癌症治疗领域给病患者带来巨大生存希望,尽管临床上被大量证实有效,但CAR-T技术的安全性始终是埋在科学家心头的一根刺。专业人士介绍,CAR-T疗法在技术层面仍然面临着细胞因子风暴(CRS)、神经毒性、脱靶效应等毒副作用以及实体瘤效果不佳等问题,虽然通过技术的不断优化改进这些问题有望被缓解,但其安全可控性依然是值得注意的问题。
CDE的《要点》就指出,CAR-T细胞产品属于“活”的细胞药物,且不能耐受病毒灭活/终端灭菌处理,产品本身具有高度的“个性化”和“异质性”,生产工艺与质量控制具有较强的“复杂性”和“特殊性”。按照药品研发与申报,已受理申报资料的完整性、规范性、溯源性及质量体系和风险控制要求存在较多缺陷,影响审评进度。即使是首家申报临床的南京传奇,据悉在2018年1月完成了药理毒理、临床和药学3项技术审评后,2月所有程序倒回,重新回到待审评状态,补充材料后才于3月初再次完成审评。
据悉,CAR-T临床研究最大的障碍在于严重的不良反应,其中细胞因子风暴(CRS)最为严重。接受CAR-T临床试验的患者的死亡率突显临床方案设计改进的和新药开发监管的必要性。细胞因子风暴是指体液中短时间内出现大量细胞因子的现象,是一种严重的过度免疫应答,会引发急性呼吸窘迫综合症和多器官衰竭等严重后果。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)