CAR-T疗法Kymriah(tisagenlecleucel;之前称 CTL019)目前正被欧美药品监管机构加速审批。在美国次疗法已被授予优先审评资格,用于治疗适合自体肝细胞移植的患者或自体肝细胞移植后复发的患者;而在欧盟,此疗法用于复发/难治性 B 细胞急性淋巴细胞白血病儿科及年轻患者,以及适合自体干细胞移植的复发 / 难治性弥漫性大 B 细胞淋巴瘤患者加速审评资格。
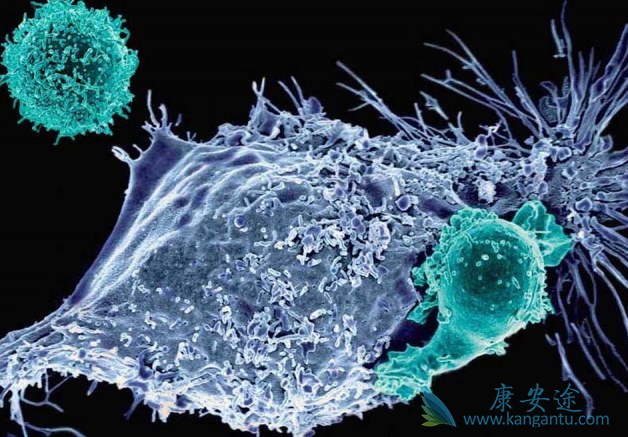
Kymriah 如果获得 FDA 与欧洲药品管理局批准,该药物将成为首个可供用于非霍奇金淋巴瘤和 B 细胞急性淋巴细胞白血病两种有明显差异适应证的 CAR-T 疗法。CAR-T 提供了一种新的治疗方法,其专门为个体患者生产。治疗过程中,T 细胞被从患者的血液中提取出来,然后在实验室中被重新编程,产生出带有基因编码 T 细胞,这种细胞可寻找病人的癌细胞。
去年 8 月份,Kymriah 成为首个获得批准的 CAR-T细胞疗法,FDA 批准该疗法用于 25 岁以上患有难治性或第二次复发或随后复发的 B 细胞前体急性淋巴细胞白血病患者。诺华表示,其新型疗法在这种治疗选择有限及历史结局较差的患者人群中显示出 83% 的总缓解率。诺华肿瘤全球药物发展总监 Hirawat 表示现在正密切配合欧洲药品管理局和 FDA,以将这款潜在的有变革性的疗法带给更多的患者。诺华称,该公司今年还计划在欧美之外为 Kymriah 提交注册申请,用于有难治 / 复发性弥漫性大 B 细胞淋巴瘤的儿科及年轻患者。
详情请访问 CAR-T https://www.kangantu.com/cart/














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)