2017年是CAR-T疗法的元年,两款重磅CAR-T疗法先后获批。虽然这一革命性疗法为患者带来了曾经难以企及的治疗希望,但它仍存在一些问题亟待解决,比如疾病复发、治疗毒性和特异性杀伤等问题。为了解决这些问题,波士顿大学(Boston University)的Wilson Wong博士和他的团队设计了一种他们称之为“瑞士军刀”的新型CAR-T疗法,有望成为CAR-T疗法的2.0版。这一结果近日发表在世界顶级期刊《细胞》上。
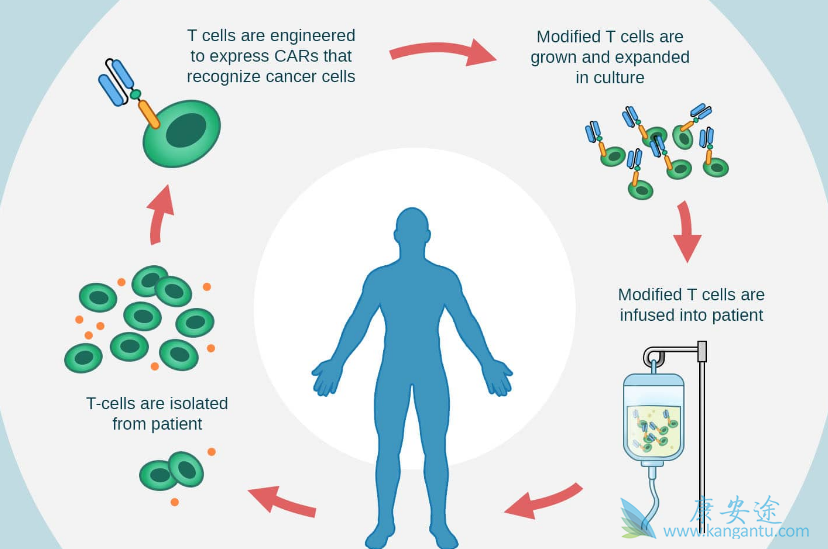
目前CAR-T疗法的治疗流程为:从患者血液中收集T细胞,然后通过基因工程使其在表面表达嵌合抗原受体(CAR),新的工程化CAR-T细胞在实验室扩增后再重新注入患者体内,对肿瘤进行特异性攻击。但Wong博士认为,目前的CAR-T疗法最大的限制是受体是一种固定的分子,CAR设计完成被T细胞表达后,就不能再被改变。这些改造过的T细胞被输注回患者体内后,只能任其发挥作用。如果一切如愿则皆大欢喜,但如果事与愿违,则可能发生危险的副作用——细胞因子释放综合征。癌细胞还可能通过抗原逃逸的过程不再表达被识别的抗原,从而躲过CAR-T细胞的追踪,造成癌症复发。
为了改善CAR-T疗法的这些局限性,比如应用范围窄、缺乏灵活性和不可调控强度等,Wong博士的团队创建了一个分离、通用和可编辑(SUPRA)的CAR系统。该技术不是依靠单一的固定CAR,而是将其分离成双组分受体系统:包含在T细胞上表达的通用受体zipCARs,和衔接分子(adaptor molecules)zipFv,后者携带可识别癌细胞特定抗原的抗体。这两种组分通过亮氨酸拉链彼此拉合,引导工程化T细胞寻找并摧毁癌细胞。














请简单描述您的疾病情况,我们会有专业的医学博士免费为您解答问题(24小时内进行电话回访)